Welke stappen zijn nodig om van een watermonster met behulp van environmental DNA (eDNA) te komen tot een soortenlijst? Welke terminologie hoort daarbij? En welke overwegingen zijn belangrijk voor de betrouwbaarheid van de data?
Download hier de pdf van dit artikel
Geschreven door Krijn Trimbos (Universiteit Leiden), Kevin Beentjes (Naturalis Biodiversity Center), Michiel Hootsmans (KWR Water Research Institute)
Vier jaar geleden publiceerde STOWA de Deltafact ‘DNA-technieken voor waterbeheerders’ [1], waarin het gebruik van moleculaire tools voor water(kwaliteits)monitoring werd toegelicht. De (e)DNA-wereld staat niet stil. Sinds het verschijnen van de Deltafact is er op diverse onderdelen in de keten van monstername tot rapportage meer onderzoek gedaan. Ondanks de grote voordelen van aquatische biomonitoring op basis van eDNA ten opzichte van conventionele benaderingen, zijn er belangrijke uitdagingen die betere toepassingen in de weg staan.
Het gaat onder meer om het voorkomen van vals positieve en -negatieve uitslagen, de vergelijkbaarheid met traditionele (op morfologie gebaseerde) meetmethoden, de noodzaak tot standaardisatie van eDNA-technieken en de mogelijkheden om dichtheden en/of biomassa te bepalen. Dit artikel staat stil bij een aantal uitdagingen en ontwikkelingen in het eDNA-werkveld. Ook wordt een aantal recente innovaties besproken en een perspectief geschetst van een toekomst waarin eDNA een grote(re) rol speelt.
Vals-positieven en vals-negatieven
Een van de meest urgente uitdagingen is het ontwikkelen van een strategie om vals-negatieve (een soort is aanwezig maar wordt niet opgepikt) en vals-positieve uitslagen (de soort is niet aanwezig maar wordt wel opgepikt) te detecteren.
Vals-negatieve signalen kunnen worden veroorzaakt doordat (1) een soort zeldzaam is en dus niet overal in het bemonsterde waterlichaam voorkomt, (2) de soort te weinig DNA achterlaat in het milieu, of (3) de gebruikte methode niet nauwkeurig genoeg is om de gezochte soort te detecteren. Gelukkig zijn er voor al deze situaties oplossingen, waarbij voornamelijk van tevoren goed wordt nagedacht over de bemonstering. Voor zeldzame soorten kunnen meer monsters verzameld worden.
Dit is mogelijk doordat eDNA-analyses over het algemeen goedkoper zijn dan traditionele vormen van biomonitoring. Als een soort te weinig DNA achterlaat kan de monsterstrategie worden aangepast op basis van de ecologie van de soort, of door monsters te nemen op specifieke plekken of tijdstippen. Als een soort zich voornamelijk ophoudt op de bodem, kunnen de monsters beter dicht bij de bodem worden genomen. Op deze manier kan de detectiekans van de doelsoort met eDNA worden vergroot. Ten slotte kan de soort-specificiteit van een methode makkelijk getest worden in een goed opgezette laboratoriumstudie.
Vals-positieve signalen kunnen worden veroorzaakt doordat (1) er iets in het monster terecht komt tijdens de bewerking, dat er aanvankelijk niet in zat (contaminatie), (2) er DNA in het monster terecht komt van een vreemde soort, bijvoorbeeld via een langsvliegende vogel, (3) eDNA niet direct wordt afgebroken maar wel verspreid in het aquatische ecosysteem, (4) DNA vanuit andere bronnen wordt getransporteerd naar de monsterlocatie, bijvoorbeeld via afwatering [2].
Oplossingen
Er zijn oplossingen voorhanden. Met genoeg controles in lab en veld kan contaminatie meestal wel vastgesteld worden [3]. Door in het veld meerdere monsters te nemen, zowel ruimtelijk als door de tijd, kunnen toevallige verontreinigingen als vogelpoep worden uitgesloten. Deze signalen zullen immers niet consistent in een waterlichaamvoorkomen.
DNA-degradatie - en daarmee de ‘leeftijd’ van het eDNA in een systeem - kan bestudeerd worden door te kijken naar de verdeling van de grootte van de DNA-fragmenten in een monster. Uit onderzoek is gebleken dat het aantal grote fragmenten langzamer afneemt dan dat van kleine DNA-fragmenten, als een organisme geen DNA meer afscheidt [4].
Het gevaar dat een vals-positief signaal door transport van elders op de monsterlocatie terechtkomt is vaak lastiger te ondervangen. Hiervoor is een inzicht in het systeem nodig, op zowel ecologisch als hydrologisch vlak. Als in een monster uit een rivier dicht bij een Nederlandse haven een signaal van haring of zalm wordt opgepikt, kan kennis van de stroomsnelheid en -richting helpen om in te schatten of dit signaal potentieel uit de haven komt. Tevens kan door ecologische kennis over de soorten in kwestie helpen om een inschatting te maken of een signaal vals of echt positief is.
DNA versus morfologie
Een probleem van meer tijdelijke aard is het ontbreken van soorten in de DNA-referentiedatabank. Voor macrofauna is het beeld al heel compleet [5]. Het aantal soorten in Nederland is niet oneindig groot, maar het compleet krijgen van de DNA-referenties kost veel werk. In het kader van het project ARISE [6] werkt Naturalis Biodiversity Center aan een DNA-referentiebibliotheek voor alle meercellige organismen in Nederland. Momenteel is van bijna 60 procent van de Nederlandse soorten een DNA-profiel bekend.
Met het groeien van de DNA-referentiedatabanken zullen identificaties op basis van DNA steeds betrouwbaarder worden, hoewel er altijd verschillen zullen blijven bestaan tussen traditionele, op morfologie gebaseerde monitoring en eDNA-monsters. Die zijn ten dele te verklaren door de resolutie van de beide methoden. Sommige soorten zijn op basis van DNA niet goed te onderscheiden, omdat er bijvoorbeeld hybridisatie optreedt, zoals bij de beek- en rivierdonderpad.
Aan de andere kant kan DNA een oplossing bieden als soorten morfologisch moeilijk te onderscheiden zijn, zoals de larven van verschillende vliegen en muggen. In een vergelijking tussen identificatie met morfologie en DNA-metabarcoding van KRW-monsters zijn bijvoorbeeld vijf verschillende geslachten van knutten (Ceratopogonidae) gevonden met DNA-analyse. De traditionele analyse kon deze alleen op familieniveau determineren [7].
eDNA wordt vooral veel ingezet voor vissen, omdat deze daarmee relatief makkelijk zijn te detecteren. Diverse recente studies laten zien er vaak meer soorten vissen worden gevonden via eDNA-metabarcoding dan met traditionele monitoring [8]. Zo werd bijvoorbeeld in een onderzoek in 2019 in een meer in de Verenigde Staten gekeken naar 60 visfuiken, waar steeds bij iedere fuik 3 watermonsters werden verzameld. In de fuiken werden slechts 12 soorten aangetroffen. Met eDNA waren dat er 40, waaronder de 12 soorten uit de fuiken [9].
In een onderzoek in het stroomgebied van de Dommel werden meer soorten gedetecteerd met alleen eDNA, tegenover slechts één (de beekprik) met alleen elektrovissen (afbeelding 1). Voor de soorten die wel met eDNA werden gevonden, waren er verschillende redenen waarom dit niet per definitie vals-positieven waren. Zo kwam het DNA van steuren waarschijnlijk uit kweekvijvers, bleken sportvissers Atlantische forel te hebben uitgezet in de Tongelreep en zijn de inheemse sneep en de uitheemse dwerggrondel vrij zeldzaam [10].
Bij de DNA-identificatie van vissen gebruikt niet elke onderzoeker dezelfde marker. Dit kan leiden tot verschillen tussen de soortenlijsten die uit de analyse komen, omdat het onderscheid tussen soorten dan niet altijd gelijk is (met sommige markers kunnen nauw verwante soorten minder goed worden onderscheiden), of omdat de referenties niet compleet zijn. In de hierboven genoemde studie in de VS vond men weinig verschil in het gedetecteerde aantal soorten bij twee soorten markers (12 en 16), maar in een ander onderzoek werden juist structureel meer soorten (16) gedetecteerd. Daar werd echter ook geconcludeerd dat het combineren van beide markers een meerwaarde had [11].
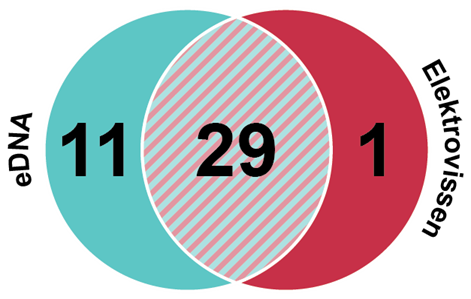
Afbeelding 1. Waargenomen vissen in het stroomgebied van de Dommel, met eDNA tegenover elektrovissen
Standaardisatie of maatwerk
Er wordt veel gesproken over standaardisatie van de verschillende stappen in het proces van DNA-monstername tot data-analyse. In twee Europese projecten zijn recentelijk ringtesten uitgevoerd. Laboratoria verwerkten op verschillende manieren dezelfde set monsters en DNA-extracten, om inzicht te krijgen in de effecten van verschillende laboratoriumprotocollen en bioinformatica-pijplijnen op de uiteindelijke soortenlijsten en kwaliteitsscores. De algemene conclusies hieruit waren dat kleine verschillen die ontstaan door bijvoorbeeld afwijkingen in de DNA-extracties, nagenoeg geen effect hadden op het eindresultaat [12], [13].
Uiteraard betekent dit niet dat alle metabarcoding-datasets altijd direct met elkaar te vergelijken zijn. Maar het geeft wel aan dat als er gebruik gemaakt wordt van één en dezelfde DNA-referentiedatabank en -interpretatie, de exacte verwerking van de monsters niet van grote invloed lijkt te zijn.
Een heel strikt voorgeschreven methode voor eDNA-analyse lijkt dus niet per se noodzakelijk. Dit is waarschijnlijk ook lastig te realiseren door inhoudelijke en technische voorkeuren van betrokken laboratoria. Het is beter om de gebruikte methodiek in overleg met het betreffende laboratorium goed af te stemmen op de vraagstelling. Maar maatwerk betekent niet dat er geen standaardisatie mogelijk is, door bijvoorbeeld te zorgen dat op de goede momenten in het traject de juiste controles worden meegenomen, zoals ook besproken in de Deltafact.
Door de monstername goed af te stemmen op de te onderzoeken soorten, is bovendien tijd te winnen in de bemonstering en de verwerking van monsters in het veld. Bij een onderzoek naar de verspreiding van de kwabaal in de Beerze werd het een stuk makkelijker om twee liter water te filteren bij gebruik van filters met poriegrootte van 5µm in plaats van 0,45µm, doordat poriën niet verstopt raakten door organisch materiaal. Voor de detectie van eDNA van vissen is een poriegrootte van 5µm voldoende. Op deze manier werden grote verschillen gevonden in verspreiding van de kwabaal tussen februari en september, mogelijk te koppelen aan de paai (kennelijk op één locatie) en verspreiding later in het jaar op diverse plekken stroomafwaarts (afbeelding 2).
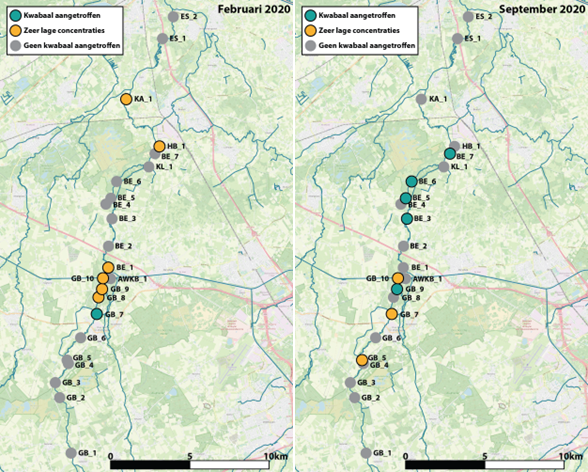
Afbeelding 2. Resultaten van eDNA-onderzoek naar voorkomen van de kwabaal in de Beerze. Links de resultaten in februari 2020, rechts die in september 2020. Locaties met een positief signaal voor de kwabaal in groen, met zeer lage DNA-concentraties in geel en zonder signaal (afwezig) in grijs
Dichtheden, biomassa en abundantie
Een van de grotere uitdagingen op het vlak van eDNA-applicaties in het waterbeheer is het bepalen van biomassa en abundantie aan de hand van DNA-concentraties. Hoewel kwantitatieve PCR-methoden met enorme precisie DNA-concentraties kunnen vaststellen in een monster, is de vertaling daarvan naar aantallen organismen en/of biomassawaarden veel ingewikkelder. Dit is namelijk zeer afhankelijk van de ‘ecologie van eDNA’. De snelheid waarmee een organisme eDNA afscheidt hangt onder andere af van de soort en de tijd van het jaar.
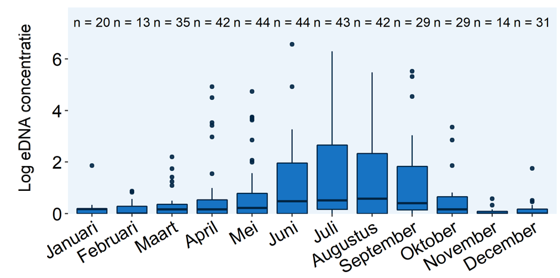
Daarnaast hangt de afbraak van eDNA af van bijvoorbeeld temperatuur en zuurgraad van het water, bacteriële activiteit, hoeveelheid UV-straling en hoeveelheid organisch materiaal (waar DNA aan kan binden). DNA-concentraties in het water kunnen zo gedurende het jaar, de maand, of zelfs de dag veranderen, bijvoorbeeld tijdens de paaitijd (afbeelding 3) of tijdens de winter als de organismen minder actief zijn.
Hierdoor kan het voorkomen dat een enkele eDNA-meting veel hogere of lagere concentraties laat zien dan de gemiddelde concentraties die bij het aanwezige aantal individuen of biomassa van die soort horen. Hierdoor kunnen mogelijk verkeerde conclusies worden getrokken over de aantallen of hoeveelheid biomassa.
Positief verband
Een directe koppeling van de gemeten DNA-concentraties met aantallen of biomassa is dus lastig te maken. Resultaten voor DNA-concentraties over tijd en ruimte dienen vooral als relatief eenvoudig verkrijgbare informatie over mogelijke verschillen in abundanties tussen locaties en door de tijd. Een breed scala aan wetenschappelijke artikelen laat zien dat er - zowel in het lab als in het veld - een positief verband is tussen eDNA-concentraties en de biomassa of het aantal individuen van een soort [14]. Hierbij moet echter wel gezegd geworden dat dit verband het sterkst is bij vissen [15] en amfibieën [16] maar dat het voor ongewervelden, die een heel ander afscheidingspatroon van DNA laten zien, ingewikkelder ligt [17].
Ondanks deze positieve relaties lijkt het er niet op dat eDNA-concentraties ingezet kunnen worden om heel precies abundanties of biomassa van soorten - laat staan complete levensgemeenschappen - in een omgeving te kwantificeren. Voor andere organismen dan vissen en amfibieën geldt dit nog sterker.
Twee recente onderzoeken laten zien dat abundantie-informatie maar van beperkte invloed is voor standaard ecologische kwaliteitsratio (EKR)-beoordelingen van macrofauna in het waterbeheer [18], [19] en ook bij diatomeeën zijn hier aanwijzingen voor [20]. Dat neemt niet weg dat kwantitatieve data alsnog van belang kunnen zijn voor andere waterkwaliteitsbeoordelingen, bijvoorbeeld bij vissen.
Afbeelding 3. Overzicht van de eDNA-concentraties van de quaggamossel gedurende het jaar in 2016, 2017 en 2019. De gegevens van de meetlocaties in die drie jaren zijn geaggregeerd. Boxplots geven de spreiding van de Log-eDNA-concentratie weer
Nieuwste ontwikkelingen
Verdere ontwikkelingen op het gebied van DNA-methodiek liggen enerzijds in de herziening van de protocollen om de gebruikte methoden efficiënter te maken qua gebruiksgemak, kosten, tijdsbeslag en duurzaamheid. Anderzijds wordt vooral gekeken naar de interpretatie van DNA-data en hoe deze data helpen systemen beter te begrijpen. Door bijvoorbeeld naar genetische diversiteit te kijken en soortgroepen mee te nemen die met traditionele monitoring niet worden bekeken (micro-organismen, zoöplankton), is vaak op een fijnere schaal iets te zeggen over de impact op een systeem.
In recent ecotoxicologisch onderzoek waarin resultaten van eDNA-analyse en morfologische identificatie werden vergeleken, werden vergelijkbare conclusies getrokken. Met de eDNA-methoden waren echter voor dezelfde conclusies veel minder replica’s nodig. Daarnaast was het effect van de stressoren (pesticiden en nutriënten) op meer niveaus in het voedselweb te meten [21].
In dezelfde studie werd ook een breed scala aan DNA-barcodes gevonden die niet altijd te linken waren aan een bepaalde soort, maar wel een indicatieve waarde hadden voor de aan- of afwezigheid van een of beide stressoren. Deze niet tot op soort geïdentificeerde barcodes zijn mogelijk interessant voor het ontwikkelen van de zogenaamde ‘taxonomie-vrije’ methoden die al eerder besproken werden in de Deltafact. Dit is interessant omdat voor lang niet alle soortgroepen de referentiebibliotheek compleet is.
Een laatste spannende ontwikkeling die gaande is, betreft onderzoek gericht op het bepalen van fysiologische informatie, zoals levend versus dood materiaal, of leeftijdsopbouw van een populatie. Deze zaken worden vaak nog genoemd als een beperking van eDNA-monitoring, omdat het bijvoorbeeld zo kan zijn dat er geen levende individuen meer in een systeem aanwezig zijn maar wel eDNA, omdat ook dode organismen door afbraak DNA loslaten. Voor waterbeheerders kan dit een probleem opleveren bij het gebruik van eDNA bij het bepalen van de staat van soorten of systemen.
In zeer recent onderzoek is aangetoond dat leeftijdsklassen te onderscheiden zijn bij poelslakken [22]. Met deze techniek zou het in de nabije toekomst mogelijk moeten zijn om dood en levend materiaal te onderscheiden en om leeftijdsopbouw van populaties van aquatische organismen te bepalen. Dat laatste is vooral relevant bij het in beeld brengen van de vitaliteit van de vis-levensgemeenschap.
Perspectief op de toekomst
DNA-technieken kunnen een gedetailleerde en deels heel andere indruk bieden van biodiversiteit en waterkwaliteit, mogelijk was met traditionele technieken. Groepen die voorheen nauwelijks konden worden onderscheiden, zoals bacteriën en schimmels, komen nu in al hun rijkdom in beeld. Ook potentiële en daadwerkelijk actieve biologische processen komen aan het licht door analyses aan afgeleiden van DNA, zoals ribonucleïnezuur (RNA) en enzymen.
Organismegroepen die al konden worden vastgesteld, kunnen nu eenvoudiger, sneller of gevoeliger worden geïdentificeerd. DNA-monitoring kan een in ruimte en tijd veel verfijnder beeld van biodiversiteit bieden tegen aanvaardbare kosten.
DNA-monitoring kan zeker (nog) niet alle informatie verschaffen die de traditionele methoden leveren, zoals biomassa en aantallen. Daarom blijven die methoden ook in de toekomst van belang. Met de nieuwe inzichten en mogelijkheden die DNA-instrumenten bieden, zijn echter ook andere kwaliteitsmaatstaven mogelijk. Deze ondersteunen de waterbeheerder, nog beter dan nu, bij het behouden, herstellen en vergroten van de biodiversiteit.
Langzaam maar zeker lijken veel problemen rond het gebruik van eDNA te worden opgelost. Hoewel een deel van het onderzoek nog in de kinderschoenen staat, gaan de ontwikkelingen de laatste jaren snel. Mogelijk kan eDNA nooit alle vragen oplossen die traditionele technieken (die ook hun tekortkomingen kennen) momenteel kunnen beantwoorden, of zijn de uitkomsten van een eDNA-onderzoek niet exact hetzelfde als de traditionele methodiek.
De komende jaren is het vooral belangrijk om te kijken hoe de monitoring kan worden gemoderniseerd, aangevuld en geoptimaliseerd met de informatie uit eDNA-onderzoek. Een voor de hand liggende oplossing is dat eDNA niet wordt ingezet om de huidige monitoring één-op-één te vervangen, maar om te kijken welke methodiek het beste past bij de vraagstelling. Voor het monitoren van de waterkwaliteit, de komende jaren zeker een belangrijk onderzoek, is het nu al goed mogelijk om met eDNA snel inzicht te krijgen in veranderende situaties, om zo de locaties aan te wijzen waar meer onderzoek nodig is.
Op termijn blijft de vraag of de voor waterbeheer benodigde informatie over de waterkwaliteit, na de nodige kalibratie en validatie, niet even goed kan worden verkregen met alternatieve maatlatten gebaseerd op eDNA. De potentie van eDNA is niet meer te ontkennen en zal de komende jaren een essentieel onderdeel worden van de gereedschapskist van elke waterbeheerder.
Samenvatting
Welke stappen zijn nodig om van een watermonster met behulp van environmental DNA (eDNA) te komen tot een soortenlijst? Welke terminologie hoort daarbij? En welke overwegingen zijn belangrijk voor de betrouwbaarheid van de data? Dit artikel staat stil bij een aantal uitdagingen en ontwikkelingen in het eDNA-werkveld, zoals de omgang met vals positieven en negatieven, het gebruik van biomassa, en taxonomie-vrije indices.
REFERENTIES
1. Stichting Toegepast Onderzoek Waterbeheer (2023). DNA-technieken voor waterbeheerders. https://www.stowa.nl/deltafacts/waterkwaliteit/diversen/dna-technieken-voor-waterbeheerders
2. ARISE biodiversity. https://www.arise-biodiversity.nl
3. Darling, J. A., Jerde, C. L., & Sepulveda, A. J. (2021). ‘What do you mean by false positive?’ Environmental DNA, 3(5), 879–883. https://doi.org/10.1002/edn3.194
4. Ficetola, G. F., Taberlet, P., & Coissac, E. (2016). ‘How to limit false positives in environmental DNA and metabarcoding?’ Molecular Ecology Resources (Vol. 16, Issue 3, pp. 604–607). https://doi.org/10.1111/1755-0998.12508
5. Zhao, B., Bodegom, P.M. van & Trimbos, K.B. (2021), ‘The particle size distribution of environmental DNA varies with species and degradation’. Science of the Total Environment, 797. https://doi.org/10.1016/j.scitotenv.2021.149175
6. Hoorn, B. B. van der & Beentjes, K. K. (2020). ‘Genetische biomonitoring van macrofauna’. H2O-Onine, 26 oktober 2020.
https://www.h2owaternetwerk.nl/vakartikelen/genetische-biomonitoring-van-macrofauna
7. Beentjes, K. K. et al. (2019). ‘Increased performance of DNA metabarcoding of macroinvertebrates by taxonomic sorting’. PLoS ONE, 14(12), e0226527. https://doi.org/10.1371/journal.pone.0226527
8. Herder, J.E, M. Groen & J. Kranenbarg (2022). eDNA-metabarcoding vissen. Onderzoek naar de mogelijke toepassing van eDNA voor de KRW vismonitoring (2018-2021). RAVON/STOWA rapport 2022-30. https://www.stowa.nl/publicaties/edna-metabarcoding-vissen-onderzoek-naar-de-mogelijke-toepassing-van-edna-voor-de-krw
9. Gehri, R. R., Larson, W. A., Gruenthal, K., Sard, N. M., & Shi, Y. (2020). ‘eDNA metabarcoding outperforms traditional fisheries sampling and reveals fine-scale heterogeneity in a temperate freshwater lake’. Environmental DNA, 3(5), 912–929. https://doi.org/10.1002/edn3.197
10. Beentjes, K. K., & Hoorn, B. B. van der (2020). Vismonitoring in de Dommel met eDNA. BioMon rapport 2019.03 https://biomon.nl/e2/biomon/site/custom/site/upload/file/publicaties/2020/vismonitoring_in_de_dommel/rapportage_201903_v3.pdf
11. Schutter, M., Kessel, N. van, Bochove, K. van, Hootsmans, M., & Kardinaal, E. (2019). Effectiviteit van eDNA metabarcoding voor vismonitoring rijkswateren. Bureau Waardenburg rapport 19-147. https://edepot.wur.nl/562458
12. Vasselon, V. et al. (2021). ‘The Fellowship of the Ring Test: DNAqua-Net WG2 initiative to compare diatom metabarcoding protocols used in routine freshwater biomonitoring for standardisation’. ARPHA Conference Abstracts, 4. https://doi.org/10.3897/aca.4.e65142
13. Bulcke, L. van den et al. (2023). ‘DNA metabarcoding on repeat: Sequencing data of marine macrobenthos are reproducible and robust across labs and protocols’. Ecological Indicators, 150, 110207. https://doi.org/10.1016/j.ecolind.2023.110207
14. Tillotson, M. D. et al. (2018). ‘Concentrations of environmental DNA (eDNA) reflect spawning salmon abundance at fine spatial and temporal scales’. Biological Conservation, 220, 1–11. https://doi.org/10.1016/j.biocon.2018.01.030
15. Rourke, M. L. et al. (2022). ‘Environmental DNA (eDNA) as a tool for assessing fish biomass: A review of approaches and future considerations for resource surveys’. Environmental DNA, 4(1), 9–33. https://doi.org/10.1002/edn3.185
16. Li, W. et al. (2021). 'Validating eDNA measurements of the richness and abundance of anurans at a large scale’. Journal of Animal Ecology, 90(6), 1466–1479. https://doi.org/10.1111/1365-2656.13468
17. Trimbos, K. B. et al (2021). ‘Stirring up the relationship between quantified environmental DNA concentrations and exoskeleton-shedding invertebrate densities’. Environmental DNA, 3(3), 605–618. https://doi.org/10.1002/edn3.157
18. Beentjes, K. et al. (2018). ‘The influence of macroinvertebrate abundance on the assessment of freshwater quality in The Netherlands’. Metabarcoding and Metagenomics, 2, e26744. https://doi.org/10.3897/mbmg.2.26744
19. Buchner, D. et al. (2019). 'Analysis of 13,312 benthic invertebrate samples from German streams reveals minor deviations in ecological status class between abundance and presence/absence data’. PloS one, 14(12), e0226547. https://doi.org/10.1371/journal.pone.0226547
20. Hootsmans, M.J.M., Beentjes, K.K., Hoorn, B.B. van der, & Wal, J., van der (2021). ‘Gebruik van DNA voor inzicht in biologische waterkwaliteit met diatomeeën’. H2O-Online, 10 november 2021. https://www.h2owaternetwerk.nl/vakartikelen/gebruik-van-dna-voor-inzicht-in-biologische-waterkwaliteit-met-diatomeeen
21. Beentjes, K. K. et al.. (2022). ‘Environmental DNA metabarcoding reveals comparable responses to agricultural stressors on different trophic levels of a freshwater community’. Molecular Ecology, 31(5), 1430–1443. https://doi.org/10.1111/mec.16326
22. Zhao, B., Bodegom, P.M. van & Trimbos, K.B. (2022), ‘Environmental DNA methylation of Lymnaea stagnalis varies with age and is hypermethylated compared to tissue DNA’. Molecular Ecology Resources, 00, 1-11. https://doi.org/10.1111/1755-0998.13691