In toenemende mate wordt conventionele monitoring van aquatische biodiversiteit aangevuld met genetische biomonitoring. Vooral bij de monitoring van vissen en amfibieën wordt analyse van environmental DNA in water toegepast.
Download hier de pdf van dit artikel.
Geschreven door Berry van der Hoorn en Kevin Beentjes (Naturalis Biodiversity Center, BioMon Netherlands Center for Genetic Biodiversity Assessment)
Macrofauna is een verzamelnaam voor ongewervelde organismen die in zoetwater leven en met het blote oog zijn te onderscheiden. Onder macrofauna vallen insectengroepen zoals waterkevers, dansmuggen en libellen, maar ook weekdieren en wormen. Deze organismen fungeren als een belangrijke indicator voor de waterkwaliteit en zijn om die reden opgenomen in het monitoringsprogramma voor de Europese Kaderrichtlijn Water (KRW). Volgens een strikt protocol worden met een handnet waterlichamen bemonsterd om de soortensamenstelling te bepalen [1]. De verzamelde diertjes worden gesorteerd, geïdentificeerd en geteld door getrainde specialisten. Op basis van de aanwezige soorten en hun aantallen (abundantie) wordt vervolgens een index voor de waterkwaliteit bepaald, de ecologische kwaliteitsratio (EKR).
Naturalis Biodiversity Center is samen met stichting EIS (kenniscentrum voor insecten) in 2012 begonnen met een pilotonderzoek met genetische biomonitoring voor de verspreiding van de beschermde Brede geelgerande waterkever. Door DNA in watermonsters te analyseren werd de aanwezigheid van waterkevers in vennen vastgesteld. In de jaren daarna is het onderzoek uitgebreid naar genetische biomonitoring van meerdere aquatische soorten tegelijk. De aanname was dat genetische identificatie een bijdrage kan leveren aan structurele monitoring en maatregel-effectonderzoek, doordat de methode mogelijk goedkoper en sneller is dan conventionele methoden. Voor hetzelfde geld kunnen meer monsters in korte tijd worden geanalyseerd. Ook zijn de resultaten van verschillende laboratoria beter onderling vergelijkbaar, omdat identificaties minder afhankelijk zijn van de kennis van verschillende experts [2].
In 2014 ontving Naturalis vanwege haar onderzoek naar genetische biomonitoring een subsidie van het Gieskes-Strijbis Fonds, voor het project DNA Waterscan. Het doel van dit project was de ontwikkeling van een betrouwbare methode voor genetische identificatie van zoetwatersoorten. In dit artikel wordt verslag gedaan van de belangrijkste resultaten van het DNA Waterscan-project op het gebied van macrofauna en worden enkele praktijkvoorbeelden toegelicht.
Afbeelding 1. Een analist van Naturalis fotografeert een verzamelde kever voor DNA barcoding
DNA (meta)barcoding en environmental DNA
Het DNA van iedere soort is uniek. In veel gevallen is maar een klein gedeelte van het DNA voldoende om zelfs nauw verwante soorten van elkaar te kunnen onderscheiden [3]. Zo’n stukje DNA dat gebruikt wordt om soorten te identificeren wordt een ‘DNA-barcode’ genoemd. Deze barcode kan in het DNA worden gevonden door gebruik van twee kunstmatige stukjes DNA, de ‘primers’. Door toenemende kennis, rekenkracht en technische ontwikkelingen zijn tegenwoordig de DNA-barcodes van veel soorten tegelijkertijd te bepalen, een techniek die ‘DNA-metabarcoding’ wordt genoemd.
Met DNA metabarcoding kunnen soorten worden vastgesteld op basis van het DNA dat aanwezig is in de leefomgeving, zoals van organisch materiaal in bodems of in waterlichamen. Deze toepassingen vallen onder de noemer ‘environmental DNA’ of kortweg ‘eDNA’. Voor meer uitleg wordt verwezen naar de factsheet DNA technieken voor waterbeheerders die in opdracht van STOWA is geschreven [4].
DNA-referentiedatabases
Essentieel voor het gebruik van DNA voor macrofauna is een betrouwbare referentiedatabank met de DNA-profielen van Nederlandse soorten. Het DNA in een (water)monster wordt met de referentie vergeleken om de juiste soortnamen te vinden. Gedurende het DNA Waterscan-project en daarna is een inspanning gedaan om een zo compleet mogelijke databank met aquatische macrofauna op te stellen. Online zijn ook publieke data beschikbaar in internationale databanken zoals BOLD (Barcode of Life Database) en GenBank [5], [6], maar deze bevatten lang niet alle Nederlandse soorten en identificaties blijken regelmatig onjuist. Soorten in de collectie van Naturalis bleken vaak zeer oud, waardoor deze onbruikbaar waren om DNA af te tappen. De keuze was snel gemaakt om nieuw materiaal te verzamelen.
De eerste uitdaging lag in het opstellen van een uniforme lijst met doelsoorten. Naturalis onderhoudt de taxonomische lijst van alle meercellige soorten die ooit in Nederland zijn vastgesteld (het ‘soortenregister’) [7]. Rijkswaterstaat houdt daarnaast een lijst bij van alle taxa die zijn vastgesteld in Nederlandse wateren en daarom relevant zijn voor het Nederlandse waterbeheer (de ‘TWN-lijst’) [8]. De maatlatten van de Kaderrichtlijn Water (KRW) bevatten lijsten met soorten die relevant zijn voor de KRW-monitoring [9]. In een eerste stap heeft stichting EIS kenniscentrum insecten deze drie lijsten gesynchroniseerd, zodat de namen van soorten op de drie lijsten overeenkomen. Vervolgens is een lijst opgesteld met alle Nederlandse macrofaunasoorten. Naturalis en EIS hebben deze lijst uitgezet bij de vele taxonomische specialisten die Nederland rijk is. Deze zijn onder coördinatie van EIS het veld in gegaan om soorten te verzamelen, te determineren, te registreren en aan te leveren.
Afbeelding 2. De verzamelde waterkevers voor DNA waterscan worden opgespeld en gaan de collectietoren in
Tot nu toe zijn in totaal 4.325 exemplaren aangeleverd van 1.236 soorten macrofauna (zie tabel 1). Sommige soorten zijn in Nederland zeldzaam, maar in de buurlanden veel algemener. Daarom zijn ook net over de grens exemplaren verzameld. Het verzamelen leidde tot waarnemingen van soorten die reeds lang of nog nooit in Nederland of buurlanden waren gezien en zelfs tot de ontdekking van soorten die nieuw waren voor de wetenschap [10]. Alle aangeleverde soorten zijn gefotografeerd, geprepareerd en opgenomen in de nationale collectie van Naturalis. Hierdoor zijn deze te allen tijde te controleren als taxonomische inzichten veranderen. Een klein gedeelte van elk exemplaar (zoals een pootje voor de meeste insecten) is gebruikt om DNA uit te halen en de genetische code te bepalen. Dit heeft 2.444 DNA-barcodes opgeleverd voor 1.078 soorten.
Tabel 1. Tussentijdse resultaten van de verzameling macrofauna
Voor soorten die tot dusver niet werden aangetroffen zijn DNA-barcodes van internationale publieke databases, zoals BOLD, gebruikt als aanvulling, na een strenge kwaliteitscontrole. Alles bij elkaar biedt het verzamelde DNA een dekking van 90% van de soorten van de KRW-maatlatten (zie afbeelding 3). Dit vormt een stevige basis voor genetische biomonitoring van macrofauna.

Afbeelding 3. Dekking van de DNA-referentiedatabank voor de soorten van de Kaderrichtlijn Water
Bulkmonsters
Om te onderzoeken of DNA-metabarcoding van macrofaunasoorten vergelijkbare resultaten oplevert als met de conventionele methoden zijn allereerst bulkmonsters geanalyseerd. Bulkmonsters zijn monsters inclusief de dieren zelf, zoals die voor de conventionele KRW-monitoring worden verzameld. Voor dit onderzoek is gebruik gemaakt van 25 oude KRW-monsters van Hoogheemraadschap van Rijnland uit 2010 en 2012, die in het archief van Aquon werden bewaard. De monsters waren per meetpunt opgesplitst naar soortgroep (wormen, kreeftachtigen, kevers/wantsen, weekdieren, schietmotten/libellen/steenvliegen en dansmuggen/overige vliegen) en opgeslagen in potjes. De inhoud van de separate potjes is vermalen in een blender waaruit DNA is gehaald. Op basis van deze DNA-mengsels zijn met generieke primers de DNA barcodes en de aanwezige soorten per potje vastgesteld en vergeleken met de lijsten van Aquon waarvan de analisten de monsters hadden gesorteerd en de soorten geïdentificeerd.

Afbeelding 4. Aandeel van de soorten (gemiddelden) aangetroffen met beide methoden (geel), alleen met morfologie (rood) of alleen met DNA (blauw). Uitgesplitst in groepen: wormen (ANNE), kreeftachtigen (CRUS), kevers/wantsen (HECO), weekdieren (MOLL), schietmotten/libellen/steenvliegen (TOE) en dansmuggen en andere vliegen (REST)
Met DNA-metabarcoding werden 213 verschillende soorten gevonden [11]. De lijst van Aquon besloeg 214 soorten. De overeenkomst tussen de soortenlijsten bedroeg gemiddeld 56 procent. Met DNA werden soorten gevonden die ontbraken op de lijst van Aquon (20%) en andersom heeft Aquon soorten vastgesteld die niet zijn aangetroffen met DNA (23%). De hoogste overeenkomst werd gevonden voor wantsen en kevers (73%) en kreeftachtigen (71%), de laagste voor wormen (48%) en weekdieren (54%) (zie afbeelding 4). Voor de toepassing van generieke primers (=primers voor alle soorten tegelijk) zijn de resultaten als positief beoordeeld, zeker aangezien de soortenlijsten op basis van visuele indificaties tussen analisten ook tot 30% kunnen verschillen. De resultaten van DNA-barcoding geven in soortenaantallen een vergelijkbare steekproef als de resultaten van visuele identificaties. Bovendien zijn de afgelopen twee jaar sinds de uitvoering van de analyse nog betere primers ontwikkeld voor de detectie van macrofaunasoorten, en is de referentiedatabank met honderden soorten gegroeid, waardoor nu nog meer soorten met DNA worden gedetecteerd.
Watermonsters
Voor sommige soortgroepen en ecologische vragen blijkt het voldoende om DNA uit watermonsters te analyseren, in plaats van bulkmonsters. Hierbij wordt DNA van huidcellen en uitwerpselen uit het water gefilterd. Dit levert de meeste tijds- en kostenbesparing op ten opzichte van de conventionele methoden voor macrofauna-analyses en is het minst invasief voor de dieren zelf. De uitdaging hierbij is om andere soorten dan macrofauna (bijvangst) uit te sluiten, zodat de macrofauna niet raakt ondergesneeuwd in het DNA van bacteriën, diatomeeën of vissen. Wanneer generieke primers worden gebruikt is meer dan 90% van de DNA-profielen niet afkomstig van macrofauna. Om deze bijvangst te beperken blijken specifieke primers voor soortgroepen heel succesvol, zoals voor dansmuggen en libellen.
Analyse van watermonsters voor macrofauna is al ingezet in de praktijk. Zo is met DNA-metabarcoding gekeken naar het voorkomen van dansmuggen in het Omval-Kolhornkanaal [12]. De provincie Noord-Holland en Hoogheemraadschap Hollands Noorderkwartier hebben de afgelopen jaren natuurvriendelijke oevers aangelegd om dit kanaal om te vormen tot een natuurverbinding en op deze manier bij te dragen aan het herstel van biodiversiteit. Naturalis heeft watermonsters verzameld en het DNA geanalyseerd op onder andere dansmuggen. Uit de studie bleek dat langs natuurvriendelijke oevers meer soorten dansmuggen worden aangetroffen dan langs de controles (steile oevers), en dat het type natuurvriendelijke oever van invloed is op het aantal dansmuggen (afbeelding 5).
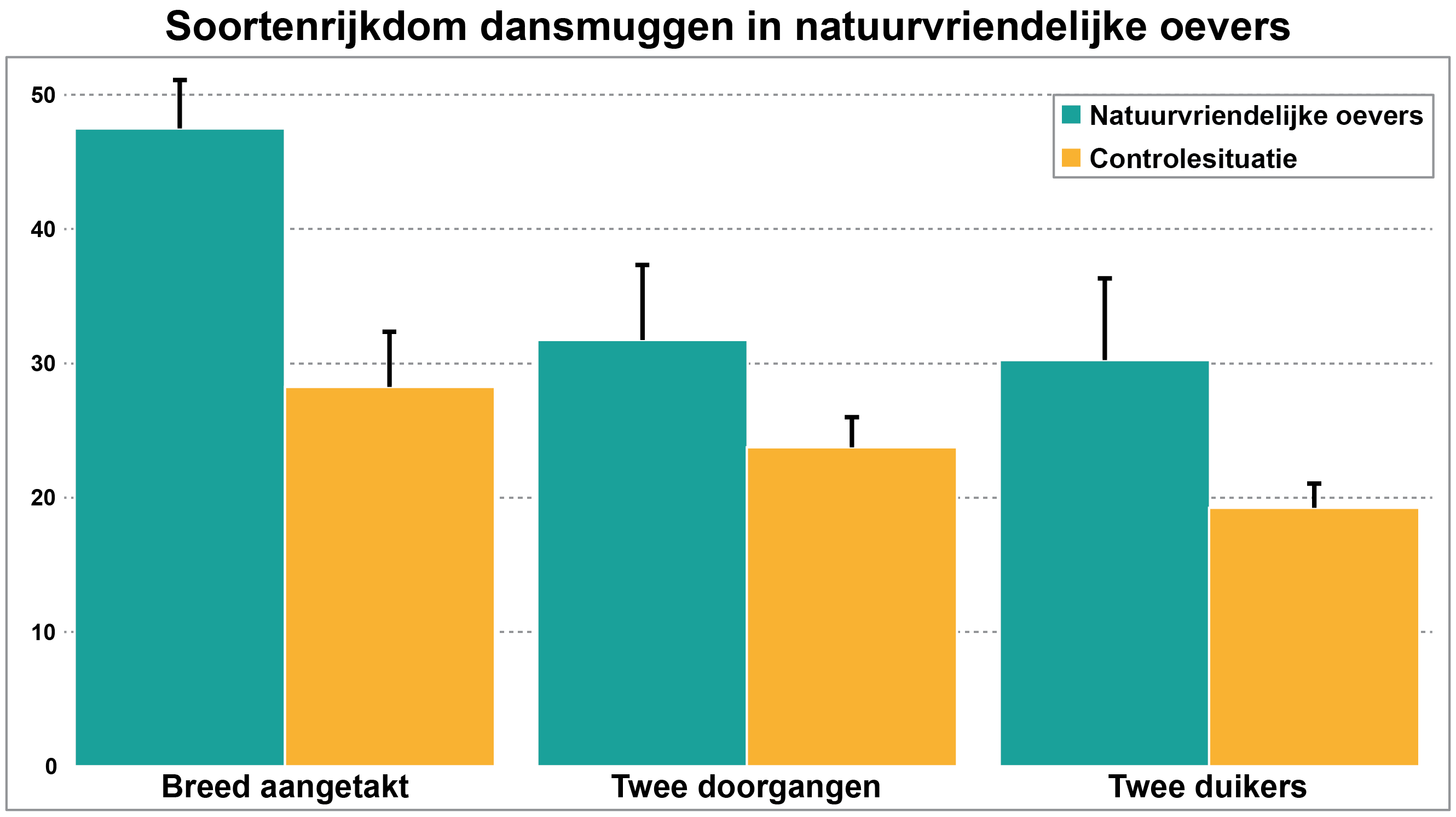
Afbeelding 5. Aantallen aangetroffen soorten dansmuggen langs de natuurvriendelijke oevers en de controlelocaties
Een tweede voorbeeld met watermonsters en dansmuggen betreft een ecologische impactanalyse naar het effect van pesticiden op onder andere dansmuggen [13]. In een faciliteit met 36 semi-natuurlijke sloten op het terrein van de Universiteit Leiden (het ‘levend lab’) kon worden aangetoond dat de soortensamenstelling van dansmuggen onder druk van het bestrijdingsmiddel thiacloprid sterk veranderde (afbeelding 7). Zonder bestrijdingsmiddel waren algeneters van het geslacht Chironomus steevast de meest voorkomende groep in de sloten, onder druk van de thiacloprid verschoof het evenwicht en begonnen predatoren van het geslacht Procladius te domineren.
Afbeelding 6. Monstername in het Levend Lab voor DNA-analyses van de biodiversiteit

Afbeelding 7. Samenstelling van de dansmuggen in sloten onder druk van insecticide, vergeleken met de controlesituatie. De diagrammen geven aan hoeveel DNA van elk geslacht werd gevonden
Abundantie
Een uitdaging bij toepassing van genetische biomonitoring is de bepaling van de aantallen of biomassa van soorten. De DNA-concentratie ligt voor de hand als alternatieve maat voor biomassa. Maar primers binden verschillend aan soorten, waardoor van sommige soorten ten onrechte hogere DNA-concentraties worden vastgesteld dan van andere. Bovendien laten verschillende soorten verschillende hoeveelheden DNA in de omgeving los en zijn er allerlei omgevingsfactoren in de natuur die invloed hebben op DNA-concentraties, wat vooral van belang is bij de analyse van watermonsters. Voor maatregel-effectstudies is het goed mogelijk om naar relatieve abundanties te kijken, waarbij concentraties vóór een maatregel worden vergeleken met die na de maatregel, zoals in het bovengenoemde onderzoek naar de effecten van insecticiden. Voor monitoring van uitgestrekte gebieden over lange tijdsperioden, zoals de KRW-monitoring, ligt dat anders.
De vraag is wat er zou gebeuren met de EKR-scores, mocht overgegaan worden van het registreren van aantallen soorten naar louter aan- of afwezigheid. Dit is gesimuleerd met bestaande monitoringsdata [14]. Een totaal van 1780 KRW-metingen van 23 watertypen van vier waterschappen uit de laatste tien jaar is onderzocht. Hierbij zijn EKR-scores met en zonder aantallen (aantal omgezet naar 1) met elkaar zijn vergeleken. De scores bleken verrassend sterk overeen te komen (zie afbeelding 8). Bijna 90 procent van alle metingen resulteerde in een beoordeling in dezelfde klasse als de meting waar aantallen wel werden meegenomen. De verschuivingen waren het grootst in de monsters met lage EKR-scores.

Afbeelding 8. EKR scores berekend zonder abundanties versus EKR scores berekend met abundanties. De gekleurde vierkanten geven de kwaliteitsklassen aan
Operationalisering
Voor maatregel-effectonderzoek is de analyse van macrofaunagroepen direct inzetbaar, zoals blijkt uit de onderzoeken naar de effecten van natuurvriendelijke oevers en van bestrijdingsmiddelen. Voor langdurige monitoring voor de KRW zijn nog enkele noten te kraken, met name in de keuze en vastlegging van uniforme protocollen en de kalibratie met bestaande meetreeksen. Het ligt voor de hand om een aantal jaar de conventionele en genetische monitoring naast elkaar uit te voeren voordat deze laatste kan worden opgenomen in KRW-protocollen. Als grootste drempel voor de implementatie wordt niet zozeer de beperkingen van de methode gezien, maar de acceptatie door ecologen en beleidsmakers.
Vanwege de grote potentie van genetische biomonitoring is Naturalis inmiddels met partners KWR, het Centrum voor Milieuwetenschappen van de Universiteit Leiden en BaseClear het spin-offbedrijf BioMon gestart [15], waar beide auteurs zijn gedetacheerd. Via BioMon kunnen de ontwikkelde toepassingen in de praktijk worden gebracht en aangeboden aan consultancybureaus, waterschappen en andere overheden en toch verbonden blijven aan het wetenschappelijk onderzoek voor de nodige innovatie. In opdracht van STOWA is de Deltafactsheet over environmental DNA geschreven [4].
Dankwoord
De auteurs willen het Gieskes-Strijbis Fonds bedanken voor de financiering, Daan Drukker en Bram Koese van bureau EIS voor de coördinatie van de macrofaunaverzamelingen en alle Nederlandse specialisten die hebben bijgedragen aan het verzamelen, determineren, fotograferen en prepareren van soorten, waaronder Oscar Vorst (waterkevers), Alexander Klink (dansmuggen), Harry Smit (watermijten), Daan Drukker (haften), David Tempelman (schietmotten), Dorine Dekkers (steekmuggen) en Bram Koese (kreeftachtigen en overigen). Met dank aan Aquon en Hoogheemraadschap van Rijnland voor beschikbaarstelling van KRW-monsters en de Provincie Noord-Holland en Hoogheemraadschap Hollands Noorderkwartier voor het onderzoek naar natuurvriendelijke oevers. Tevens dank aan Krijn Trimbos en Henrik Barmentlo van het Centrum voor Milieuwetenschappen in Leiden voor het gezamenlijk onderzoek in het Levend Lab.
Referenties
1. Stichting Toegepast Onderzoek Waterbeheer (2010). Handboek Hydrobiologie deel III. Biologisch onderzoek voor de ecologische beoordeling van Nederlandse zoete en brakke oppervlaktewateren. www.stowa.nl/publicaties/handboek-hydrobiologie
2. Haase, P., Pauls, S. U., Schindehütte, K., & Sundermann, A. (2010). ‘First audit of macroinvertebrate samples from an EU Water Framework Directive monitoring program: human error greatly lowers precision of assessment results’. Journal of the North American Benthological Society, 29(4), 1279–1291.
3. Hebert, P. D. N., Cywinska, A., Ball, S. L., & DeWaard, J. R. (2003). ‘Biological identifications through DNA barcodes’. Proceedings of the Royal Society B: Biological Sciences, 270(1512), 313–321. https://doi.org/10.1098/rspb.2002.2218.
4. Beentjes, K. K., Trimbos, K., Hootsmans, M., Hoorn, B. B. van der (2020). DNA technieken voor waterbeheerders. STOWA factsheet. www.stowa.nl/deltafacts/waterkwaliteit/diversen/dna-technieken-voor-waterbeheerders
5. Ratnasingham, S., & Hebert, P. D. N. (2007). ‘BOLD: the Barcode of Life Data System (www.barcodinglife.org)’. Molecular Ecology Notes, 7, 355–364. https://doi.org/10.1111/j.1471-8286.2006.01678.x
6. Benson, D. A. et al. (2012). ‘GenBank’. Nucleic Acids Research, 41(D1), 36–42. https://doi.org/10.1093/nar/gks1195
7. www.nederlandsesoorten.nl
8. https://twnlist.aquadesk.nl/
9. www.stowa.nl/publicaties/referenties-en-maatlatten-voor-natuurlijke-watertypen-voor-de-kaderrichtlijn-water-2021
10. Drukker, D., Stokvis, F., & Hoorn, B. van der (2020). ‘Ecdyonurus submontanus Landa, 1969 and Electrogena affinis (Eaton , 1887) new for Belgium (Ephemeroptera : Heptageniidae)’. Bulletin de La Société Royale Belge d’Entomologie / Bulletin van de Koninklijke Belgische Vereniging Voor Entomologie, 156, 35–48.
11. Beentjes, K. K. et al. (2019). ‘Increased performance of DNA metabarcoding of macroinvertebrates by taxonomic sorting’. PLoS ONE, 14(12), e0226527. https://doi.org/10.1371/journal.pone.0226527
12. Hoorn, B. van der & Beentjes, K. (2020). eDNA onderzoek in natuurverbinding Omval-Kolhorn. BioMon rapport 2019.02. www.biomon.nl/nl/publicaties
13. Beentjes, K. et al. (2020). ‘Environmental DNA metabarcoding reveals comparable responses to agricultural stressors on different trophic levels of a freshwater community’. Authorea. https://doi.org/10.22541/au.159236833.30909538
14. Beentjes, K. K., Speksnijder, A. G. C. L., Schilthuizen, M., Schaub, B. E. M., & Hoorn, B. B. van der (2018). ‘The influence of macroinvertebrate abundance on the assessment of freshwater quality in The Netherlands’. Metabarcoding and Metagenomics, 2, e26744. https://doi.org/10.3897/mbmg.2.26744
15. BioMon Netherlands Center for Genetic Biodiversity Assessment. www.biomon.nl



















