Deltares en het WEC van Vitens hebben een nieuwe bemonsteringsmethode met de Dual Filter Capsule getest op aanwezigheid van Legionella en Escherichia coli/enterococcen in verschillende watermatrices.
Download hier de pdf van dit artikel
Geschreven door Anniek de Jong, Julia Dorigo (Deltares), Eelco Wallaart (Sylphium), Miriam Dijkstra, Adrie Atsma (Vitens)
In de drinkwatersector worden steeds meer watermonsters geanalyseerd met moleculaire diagnostiek. De detectie van bacteriën met behulp van moleculaire technieken, zoals de kwantitatieve PCR (qPCR) en Reverse Transcriptase PCR (RT-PCR), maakt het mogelijk om op een snelle, gevoelige en betrouwbare manier ziekteverwekkers zoals Legionella pneumophila aan te tonen.
Voor moleculaire meetmethodes worden, net als bij kweekgerelateerd onderzoek, drinkwatermonsters aan de tap genomen. Deze worden verzameld in steriele flessen met conserveringsmiddel, vervolgens gekoeld naar het laboratorium vervoerd en maximaal 24 uur bewaard voordat ze worden geanalyseerd. Bij het Waterexpertisecentrum (WEC) van Vitens worden deze watermonsters door middel van filtratie geconcentreerd, waarbij de bacteriën op een filter worden verzameld. Vanaf dit filter wordt het bacterieel DNA of RNA (nucleïnezuren) geïsoleerd, dat vervolgens wordt gebruikt voor screening op L. pneumophila, Eschcerichia coli of enterococcen met PCR.
De vraag van Vitens is of de nucleïnezuren gedurende de bewaarperiode van het drinkwatermonster wel voldoende worden geconserveerd. Daarnaast kunnen drinkwatermonsters soms stoffen bevatten die met de reguliere methode moeilijk te verwijderen zijn. Deze stoffen, zoals humuszuren, kunnen voor problemen, zoals remming, zorgen bij de PCR-analyse. Vitens heeft mede hierom in samenwerking met Deltares een alternatieve wijze van monstername en conservering voor moleculaire diagnostiek onderzocht: de Dual Filter Capsule (DFC)-methode.
DFC als alternatief
De firma Sylphium heeft de DFC-methode specifiek ontwikkeld voor detectie van environmental DNA (eDNA) in oppervlaktewatermonsters. eDNA wordt gebruikt om de aanwezigheid van organismen in bijvoorbeeld water vast te stellen, op basis van DNA-sporen (bv. huidschilfers en feces) in (water)monsters die organismen in hun milieu achterlaten. Bij de DFC-methode worden unieke filters gebruikt, waarmee naast eDNA ook micro-organismen uit het water worden geïsoleerd (afbeelding 1A).
Met de DFC-methode wordt de filtratie meteen bij de monstername van het water uitgevoerd (afbeelding 1), waarna de nucleïnezuren in situ worden geconserveerd door chemicaliën aan de DFC toe te voegen, die ook voor chemische ‘lysis’ van bacteriële cellen zorgen. Lysis is een proces waarbij cellen kapot worden gemaakt en nucleïnezuren in de oplossing vrijkomen. De DFC’s kunnen, door het toevoegen van deze chemicaliën, bij kamertemperatuur worden bewaard en vervoerd, zonder dat de nucleïnezuren afbreken. In het laboratorium worden de nucleïnezuren vervolgens uit de DFC geïsoleerd met een RNA/DNA-isolatiekit.

Afbeelding 1. A) De Dual Filter Capsule van Sylphium. Het water loopt met de richting van de pijl over het filter. B) Het koppelstuk tussen een kraan en de DFC
In 2021 hebben Sylphium, Deltares en het WEC van Vitens in een studie de detectie van eDNA van waterpissebedden (Asellota) in de drinkwaterdistributie de reguliere methode en de DFC-methode met elkaar vergeleken. Tijdens dit onderzoek is 10 liter watermonster getest. Deze bemonstering verliep moeiteloos doordat de DFC met een adapter aan de waterkraan kon worden gekoppeld (afbeelding 1B). Hierdoor waren de enige handelingen op locatie het open- en dichtdraaien van de kraan en het toevoegen van de chemicaliën na afloop. Dit in tegenstelling tot de reguliere methode, waarbij een watermonster van 10 liter gekoeld getransporteerd en in het laboratorium alsnog gefiltreerd moet worden. De isolatie van het eDNA uit het filter is met de DFC-methode eenvoudig.
De DFC-methode detecteerde evenveel of meer eDNA (0% tot 65% meer genkopieën/100 mL) dan met de reguliere wijze van bemonsteren, conserveren en isoleren bij Vitens (afbeelding 2) [1]. De uitkomst van dit eDNA-onderzoek was de aanleiding om de DFC-methode te testen voor moleculaire meetmethodes.
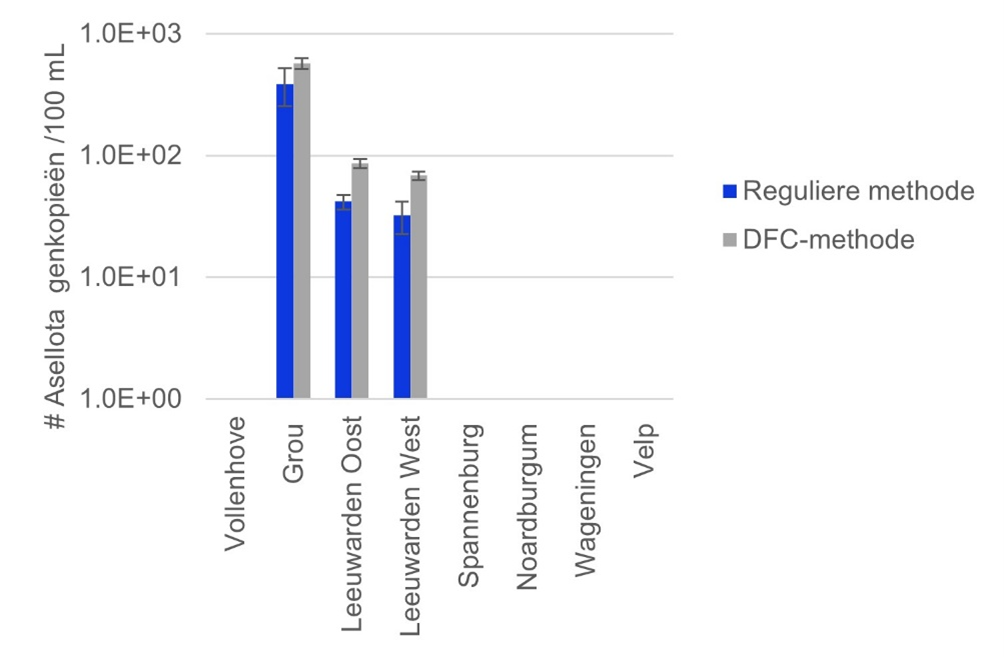
Afbeelding 2. Aantal genkopieën van waterpissebed (Asellota) per 100 mL water bij verschillende locaties uit het distributienetwerk en productielocaties (PB) van Vitens [1]
Detectie van hoge concentraties Legionella-DNA
De DFC-methode is vergeleken met de reguliere qPCR-analysemethode door tien watermonsters met verschillende concentraties L. pneumophila te analyseren. Het WEC van Vitens heeft de watermonsters gemaakt die deel opzettelijk zijn besmet (spiked) met L. pneumophila. Naast drinkwater zijn ook monsters gebruikt die van nature PCR-remmende stoffen bevatten, zoals oppervlaktewater.
De monsters zijn met de DFC’s gefiltreerd en volgens protocol geconserveerd. De DFC’s zijn vervolgens, zonder vermelding van het type monster, een dag later opgestuurd naar Sylphium. Daar is de DNA-isolatie uitgevoerd volgens de DFC-methode [2]. Deltares heeft de kwantificatie van het DNA met een qPCR uitgevoerd, waarbij het aantal gemeten genkopieën van L. pneumophila per 100 mL in een monster is bepaald.
De restanten van de watermonsters die zijn getest met de DFC-methode zijn bij Vitens en Deltares ook met qPCR geanalyseerd voor detectie van L. pneumophila, volgens de reguliere methode. Hierbij is het watermonster gekoeld in een steriele fles 22 tot 24 uur bewaard, waarna de filtratie van het drinkwatermonster over een 0,22 µm-polycarbonaatfilter (Millipore) is uitgevoerd. Daarna is DNA geïsoleerd met de DNeasy PowerBiofilm Kit (Qiagen), uitgevoerd en gekwantificeerd met een qPCR [3].
Met beide methodes werd L. pneumophila gedetecteerd (afbeelding 3). Bij een hogere concentratie L. pneumophila (>1.000 genkopieën/100 mL) geeft de DFC-methode het hoogste aantal genkopieën. Voor de andere watermonsters zijn de verschillen tussen de reguliere methode en de DFC-methode beperkt. Beide methodes detecteren zoals verwacht geen L. pneumophila in kraanwater en in de blanco.
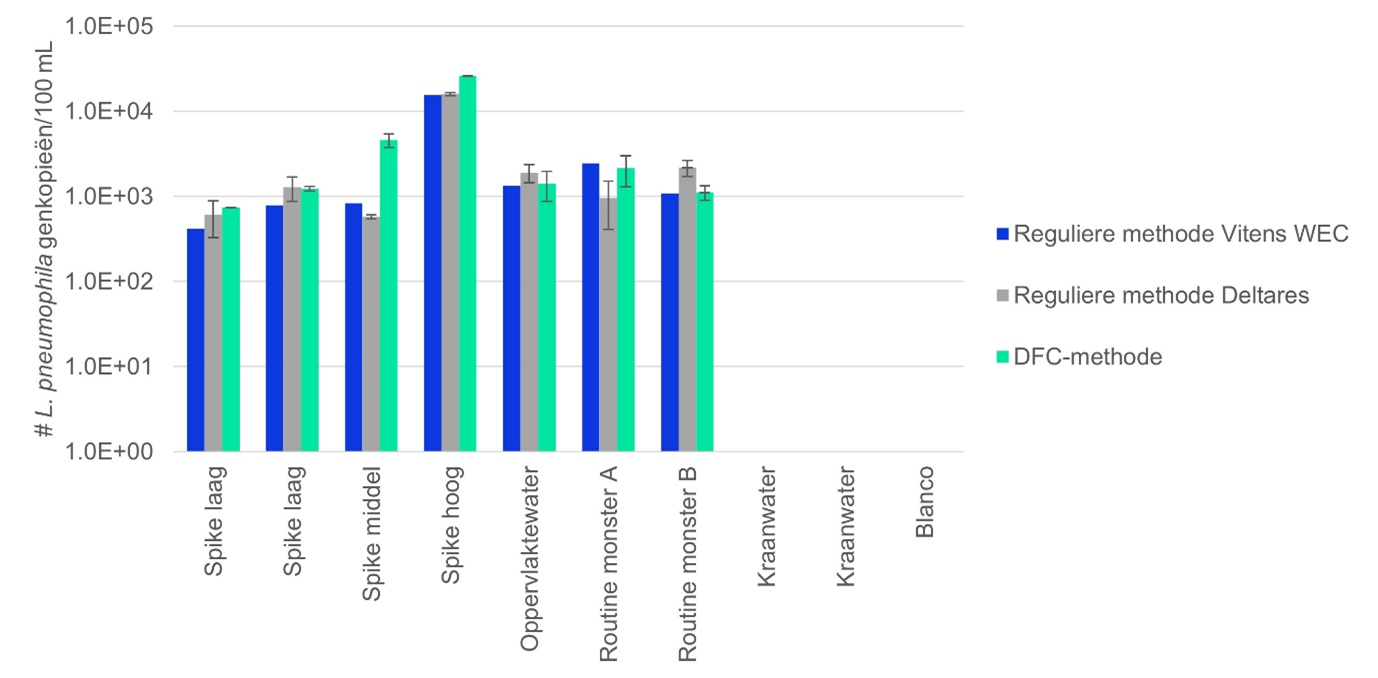
Afbeelding 3. Aantal gedetecteerde genkopieën van L. pneumophila per 100 mL water, met de reguliere methode getest door zowel Vitens WEC als Deltares, en de DFC-methode van Sylphium
Detectie van E. coli en enterococcen 16S rRNA-gen
De DFC-methode en de reguliere bemonsteringsmethode zijn ook vergeleken door tien watermonsters met verschillende concentraties E. coli en enterococcen te analyseren. Het WEC heeft de watermonsters gemaakt en heeft deze met de DFC gefiltreerd en volgens protocol geconserveerd. Ook hier zijn naast normale drinkwatermonsters ook monsters getest die veel PCR-remmende stoffen bevatten, zoals oppervlaktewater en ijzermangaan bevattend grondwater. De analyse van de DFCs is simultaan uitgevoerd door Vitens en Deltares. Na de RNA-isolatie volgens de DFC-methode is de RT-PCR gebruikt voor kwantificatie van E. coli- en enterococcen 16S rRNA-genkopieën in het monster.
Dezelfde watermonsters zijn volgens de reguliere methode door Vitens en Deltares verwerkt voor detectie van E. coli en enterococcen. Hierbij zijn restanten van de watermonsters die zijn gebruikt voor de DFC-methode, 22-24 uur gekoeld bewaard in steriele flessen. Daarna zijn een filtratie van het drinkwatermonster over een 0,4 µm-polycarbonaatfilter (Millipore), RNA-isolatie en kwantificatie van het 16S rRNA-gen met RT-PCR uitgevoerd [3].
Bij de reguliere methode komen het aantal gedetecteerde E. coli- en enteroococcen-genkopieën per 100 mL water bij Vitens WEC en Deltares overeen (afbeelding 4). Bij het WEC van Vitens worden meer E. coli-genkopieën gedetecteerd, mogelijk doordat het WEC het protocol beter onder de knie heeft. Met de DFC-methode zijn bij beide laboratoria alleen in de oppervlaktewatermonsters E. coli- en bij een spikelaag bij Deltares, 16S rRNA-genkopieën gemeten; in alle overige geteste monsters zijn geen E. coli 16S rRNA-genkopieën gedetecteerd. Met de DFC-methode zijn bij beide laboratoria in geen van de monsters enterococcen gedetecteerd.
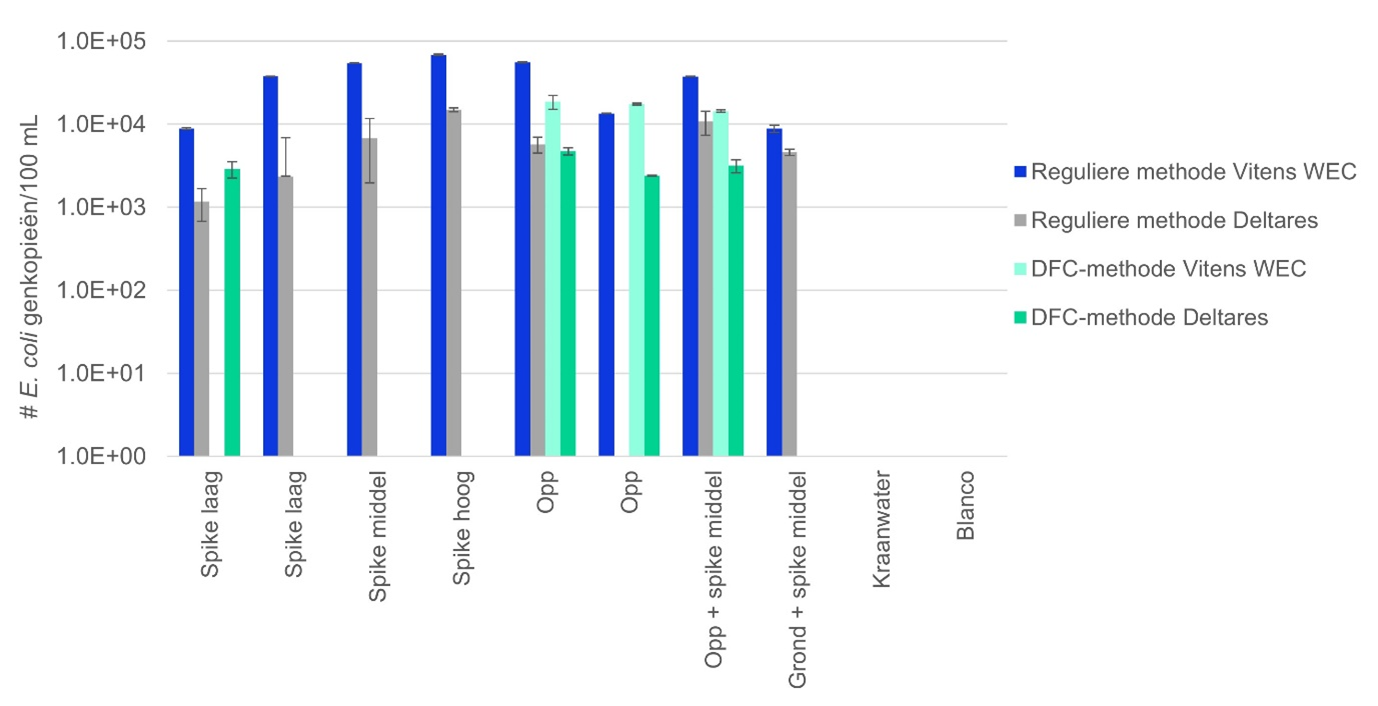
Afbeelding 4. Aantal gedetecteerde genkopieën van E. coli per 100 mL water, met de reguliere methode getest door zowel Vitens WEC als Deltares, en de DFC-methode van Sylphium ook getest door zowel Vitens als Deltares. Opp = oppervlaktewater, Grond = grondwater
Conclusies & aanbevelingen
In dit project hebben Deltares en WEC van Vitens onderzocht of de nucleïnezuren na monstername met de DFC-methode beter worden geconserveerd. Daarna kan worden bepaald of deze voorbewerkingsmethode in potentie geschikt is voor moleculaire diagnostiek voor de matrix drinkwater. De DFC-methode lijkt volgens dit onderzoek naast eDNA ook goed in staat te zijn DNA van L. pneumophila in verschillende watermatrices te conserveren en te isoleren.
In dit onderzoek is naast drinkwater ook onderzocht of met de DFC-methode vergelijkbare resultaten worden verkregen in oppervlaktewater en grondwater. Oppervlaktewater bevat veel stoffen die nadelige invloed kunnen hebben op PCR. Zo hebben bijvoorbeeld humuszuren een remmende werking op de PCR, waardoor er geen betrouwbare uitspraak kan worden gedaan over de aanwezigheid van L. pneumophila. Dit onderzoek toont aan dat gebruik van de DFC-methode op watermatrices als oppervlaktewater geen problemen bij de PCR veroorzaakt. Dit is een indicatie dat de DFC-methode de PCR-remmende stoffen in drinkwater goed verwijdert.
De conservering en isolatie van RNA met de DFC-methode is in zijn huidige vorm volgens dit onderzoek niet optimaal; de opbrengsten zijn volgens dit onderzoek lager dan met de reguliere voorbewerkingsmethode. Het isoleren van RNA uit bacteriën met een dunne celwand, zoals E. coli, gaat met de DFC-methode aanmerkelijk beter dan isolatie van bacteriën met een hardere celwand, zoals enterococcen.
Mogelijk kan de degradatie van de celwand door gebruik van andere chemicaliën en enzymen, zoals lysozym, worden verbeterd, waarbij het RNA, maar mogelijk ook DNA, beter beschikbaar wordt voor verdere analyse. Voor het isoleren van RNA uit bacteriën en nucleïnezuren uit bacteriën met een dikke celwand is voor de DFC-methode nog een optimalisatie nodig. Ook voor de matrix grondwater, die veel ijzermangaandeeltjes bevat, wil de isolatie van RNA met de huidige DFC-methode nog niet lukken.
Toch blijft de DFC-methode voor Vitens en Deltares interessant, omdat:
• er bij DFC-bemonstering geen monstervaten en koeling nodig zijn. Dit maakt vervoer en opslag van monsters voor moleculaire diagnostiek veel eenvoudiger, goedkoper en flexibeler.
• de filtratiecapaciteit van de DFC niet beperkt is tot 10 liter, maar volumina tot meer dan 60 liter drinkwater kunnen worden gefiltreerd.
• de leverancier claimt dat deze conservering beter is voor de kwaliteit van nucleïnezuren ten opzichte van de reguliere bemonsteringsmethode, mede omdat de DFC-bemonstering de enzymactiviteit, en daarmee de afbraak van nucleïnezuur, remt.
• de DFC-methode zorgt voor een substantiële reductie van het aantal handelingen en de tijd (besparing van 1 uur per 10 monsters) voor het isoleren van nucleïnezuren.
Sylphium, Deltares en het WEC van Vitens hebben de intentie om de DFC-methode verder te optimaliseren, zodat deze ook toegepast kan worden voor detectie van bacteriën met een dikke celwand en RNA-gerelateerde analyses. Met dit onderzoek is aangetoond dat de DFC-methode veel potentie heeft als voorbewerking voor moleculaire diagnostiek.
Dankwoord
De auteurs bedanken Anneke Roosma (Vitens), Jan Warmink (Sylphium) en Sharda van Willigen (Vitens) voor hun waardevolle ideeën, bijdragen en discussies gedurende het project en het schrijven van dit artikel.
REFERENTIES
1. Jong, A. de, Waals, M. van der, & Zaan, B. van der (2022). eDNA voor detectie van waterdiertjes in het distributienetwerk van Vitens. Projectnummer 11206956 BGS, Deltares.
2. Sylphium molecular ecology (2022). SYL002: Manual Environmental DNA Isolation Kit detection kit. https://drive.google.com/file/d/1fcXxarkHHFZy_1qAkXndvTMQxwztIvZf/view
3. Jong, A. de, et al. (2024). Onderzoek naar alternatieve monstername voor moleculaire diagnostiek. Projectnummer 11208261 BGS, Deltares.


















Dat was het begin van meerdere projecten in Dordrecht. Onlangs zijn nog populieren van zo,n 125 jaar oud gesnoeid om duurzaam te behouden die langs het riviertje het Wantij staan. De eerder voorgenomen kap van vele andere, 80 jaar oude bomen, werd voorkomen. Vorig jaar werd een artikel geplaatst in Trouw waarop reacties zijn gekomen uit meerdere steden.
Inmiddels zijn bewoners uit Den Haag, Rotterdam en Amsterdam zich in gaan zetten voor behoud populieren in hun omgeving. Op het blog https://blog.hetwantij.com/ vindt u meer via zoekfunctie "populieren".
Het blog wordt binnenkort geactualiseerd met de nieuwe informatie en rapporten. Graag zien we dat ook deze populieren langs de Maas een kans krijgen duurzaam oud te worden!
Secretaris Cor Goosen